2025年11月9日,全球癌症免疫治疗领域极具影响力的国际学术盛会——第40届癌症免疫治疗学会(SITC)年会在美国圆满落幕。上海细胞治疗集团及其美国公司Chantibody Therapeutics组成的中美协同团队在国际学术平台上公布了CT111和CT224两款创新免疫治疗药物的临床前数据。
这两款药物均源自近期斩获中美双专利的第四代纳米抗体VHHMAb®平台,以“专利平台+管线开发”的成果落地,清晰展现了从基础研究到应用转化的高效路径,为实体肿瘤治疗带来具有差异化优势的解决方案。

CT111:三特异性抗体实现三重机制协同抗癌 破解实体瘤治疗瓶颈
摘要编号:976
摘要题目:CT111, a PD-1 x CTLA-4 x VEGF trispecific antibody, demonstrates potent anti-tumor efficacy through synergistic immune checkpoint blockade and VEGF inhibition with cooperative avidity
CT111是一款靶向PD-1、CTLA-4和VEGF的三特异性抗体,通过单一全VHH分子实现抑制肿瘤血管生成协同激活T细胞,代表下一代免疫治疗的方向。该研究由Chantibody牵头,中美团队分工协作高效完成攻关。
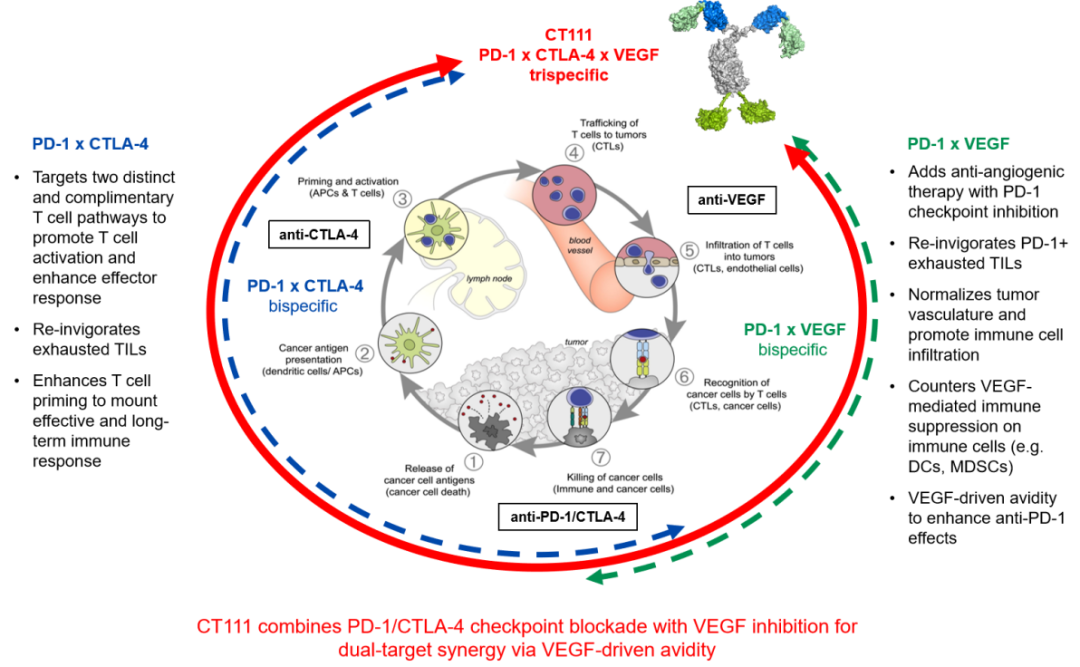
背景介绍:PD-1、CTLA-4和VEGF是肿瘤免疫治疗中已获临床验证的关键靶点,三者在抗肿瘤免疫循环反应中发挥互补作用。目前双特异性抗体和多靶点联合治疗虽已展现临床潜力,但在抗肿瘤疗效持续性和总体生存获益上仍有差距。CT111通过多特异性抗体的协同结合特性,将抗PD-1(恢复效应T细胞活性)、抗CTLA-4(T细胞启动/增殖)以及抗VEGF(抑制肿瘤血管生成)功能集于一体,有望实现更优的生物学协同效应与临床获益。
分子设计与机制:
借助多样性抗体发现和AI设计模块,研发团队成功构建出双价三靶的对称二聚抗体结构,将抗肿瘤特异性T细胞激活(CTLA-4),肿瘤抑制和T细胞浸润(VEGF),以及肿瘤微环境调控(PD-1)三大核心机制高效融合,形成“攻防兼备”的协同抗癌效应。
临床前体外数据:
CT111对于VEGF的阻断活性比其他VEGF双抗和三抗产品高出4-5倍,具有PD-1,CTLA-4和VEGF三靶点生物学活性和临床剂量高度平衡的优势,可以解决获批VEGF单抗临床剂量(10-15mg/kg)超出PD-1或CTLA-4单抗对于双抗三抗剂量选择的困境,与竞品相比具有更强的产品优势和临床优势,可拓宽安全有效的治疗窗口。CT111更进一步展现出独特的“亲和力协同效应”,与VEGF结合后,既能显著增强对PD-1(129倍)和CTLA-4(15倍)的结合和阻断能力,又避免了竞品产生的多聚体非特异结合现象,实现了1+1+1 > 3的精准协同抗癌效果。
临床前体内数据:
在体内实验中,低剂量CT111在多种肿瘤模型中实现了持久的肿瘤消退和免疫记忆,疗效显著优于临床标杆抗体。对HCC827肿瘤组织的分析显示,CT111治疗后相对PD-1/VEGF双抗竞品针对肿瘤杀伤的活化CD8+ T细胞数量增加,免疫抑制的调节性T细胞(Treg)数量减少,表明CT111中CTLA-4阻断功能对于抗肿瘤的响应和持久起到了关键作用。除了显著的疗效,由于CT111缺乏Fc效应功能,避免了正常组织中Treg的消除,为其免疫安全性提供了重要保障。
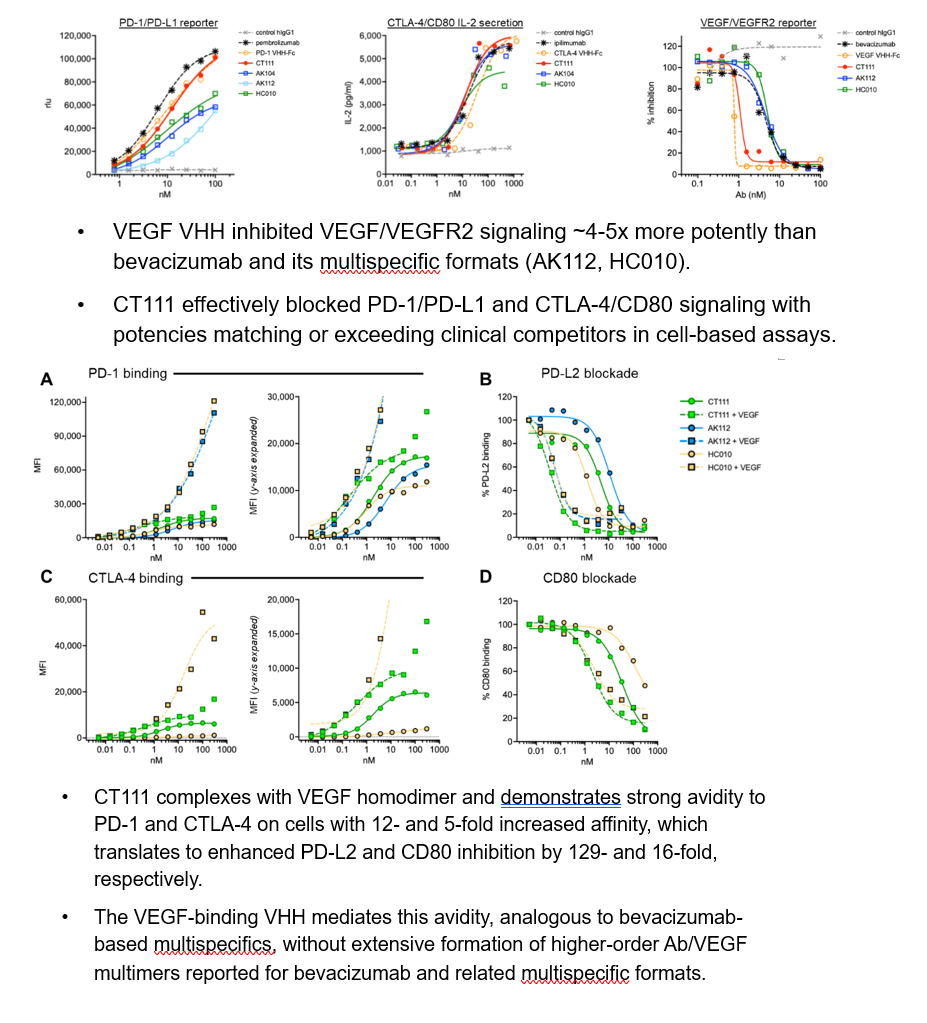
研究团队指出,CT111通过协同作用增强肿瘤特异T细胞的增殖,浸润和激活,优化三靶点结合和生物学活性的协调平衡,实现肿瘤微环境内活性和临床安全有效治疗窗口的放大。这些发现为CT111进入实体瘤临床开发,尤其是针对PD-1耐药患者的治疗和新一代PD-1多抗药物的开发提供了坚实依据。
CT224:双表位T细胞衔接器兼顾疗效与安全,突破结直肠癌治疗局限
摘要编号:958
摘要题目:CT224: A biparatopic VHH-based CDH17×CD3 T cell engager with optimized safety and efficacy for colorectal cancer
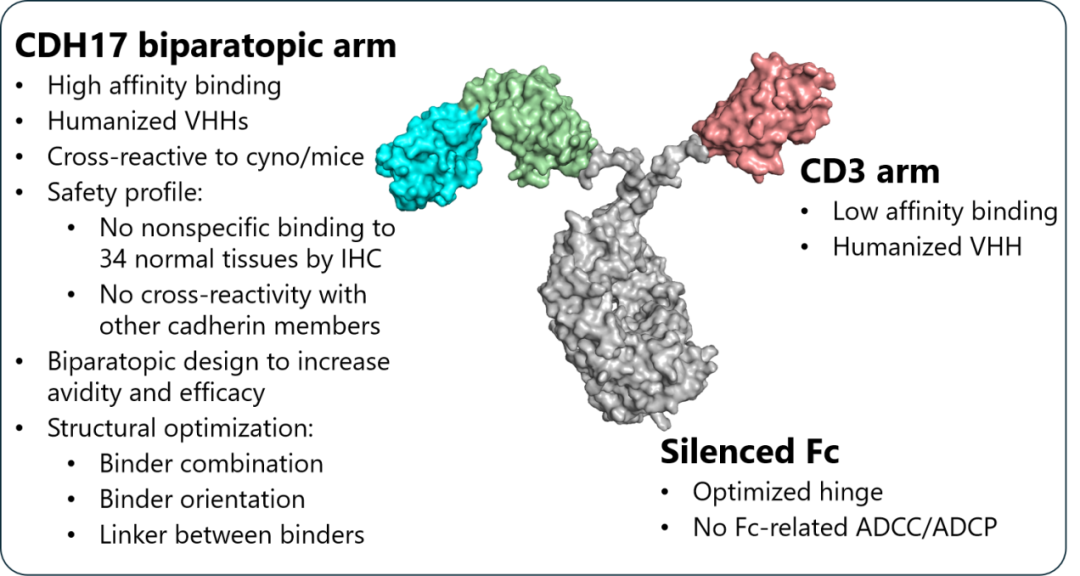
CT224是一款靶向CDH17双互补表位的CD3 T细胞衔接器(TCE)。 通过双表位结合实现对肿瘤的高特异性锚定,并利用筛选优化的低亲和力抗CD3纳米抗体降低传统TCE的毒性风险。
CT224的创新设计旨在破解传统TCE在实体瘤治疗中“疗效不足、毒性偏高”的痛点,为解决TCE在实体瘤治疗中的挑战提供新策略。该研究同样由Chantibody Therapeutics公司牵头,中美团队分工协作高效完成攻关。
背景介绍:
结直肠癌是全球范围内重大的未被满足医疗需求,钙粘蛋白-17(CDH17)在大多数结直肠癌中高表达,与不良预后及生存期缩短相关。在正常肠道组织中,CDH17局限于紧密连接,而在肿瘤中异常高表达且定位改变,使其成为理想的肿瘤治疗靶点。然而,现有TCE在实体瘤中的应用受限于靶点特异性不足、CD3抗体活性调控困难及肿瘤穿透性差等问题。
分子设计与机制:
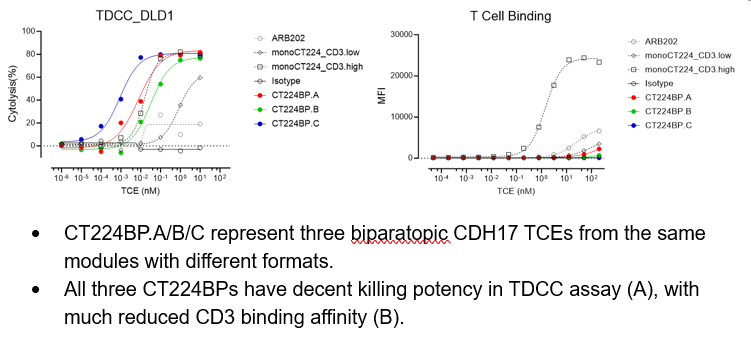
基于第四代纳米抗体VHHMAb®平台,研究团队成功获得了覆盖CDH17七个胞外域亲和力差距千倍的CDH17 VHH抗体库,以及具备不同CD3结合活性的CD3 VHH抗体库。利用AI平台设计以及高通量功能筛选,系统性的对CDH17双表位、CD3抗体选择以及Linker选择,进行设计与优化。最终候选分子CT224展现出强效的肿瘤杀伤能力。
临床前体外数据:
在CD8T细胞介导的体外TDCC实验中,相对于单表位抗体和ARB202 (Benchmark),双表位CT224展现出pM级别的EC50,表明其具备极强的肿瘤杀伤活性。在PBMC无靶细胞共孵育实验中,背景T细胞激活及细胞因子释放水平极低,体现出优异的安全性。CT224还具备良好的成药性特征,包括1g/L以上的高表达量、高纯化纯度、低多反应性及优异的热稳定性(Tm高于65度),为其进入临床开发奠定了坚实基础。此外,CT224的抗体可与人源、食蟹猴及鼠源CDH17交叉反应,为临床前研究及转化应用提供了便利。
临床前体内数据:
在PBMC人源化小鼠COLO205肿瘤模型,以及HSC人源化小鼠DLD1肿瘤模型中,CT224的肿瘤生长抑制效果均优于ARB202(Benchmark),并且具备剂量依赖的肿瘤抑制效果。同时在食蟹猴PK实验探索中,CT224展现出类IgG的6-7天半衰期特征,表明其在人体内可能具备良好的给药频率优势。
研究结论表明,CT224作为新型双表位CDH17×CD3 TCE,兼具强效抗肿瘤活性与良好安全性,其小分子尺寸更有利于肿瘤穿透,有效解决了现有TCE在实体瘤治疗中的关键局限。其跨物种反应性、优异药代动力学及成药性特征,支持其作为首款针对结直肠癌的双表位TCE开展进一步临床前开发及临床转化。
中美协同:从技术专利到临床潜力的高效转化
“如果说第四代纳米抗体平台的中美双专利是‘蓄能’,那么此次SITC公布的双药成果就是‘释能’。”上海细胞治疗集团董事长兼CEO钱其军教授表示,平台的AI设计与高特异性筛选优势,让CT111的三靶点协同、CT224的双表位精准结合成为可能,而中美团队的分工协作则加速了成果落地——集团依托丰富的羊驼资源和抗体发现技术提供多样化高质量的单靶纳米抗体,Chantibody凭借美国本土的抗体工程技术优势和多抗产品开发经验主攻分子优化和产品推进, “技术同源、优势互补”的模式让创新效率倍增。
Chantibody总裁、首席科学官许文峰博士补充道,“作为中美协同开发的VHHMAb®平台的中美双专利授权意义重大,它不仅验证了我们底层技术的原创性与国际竞争力,更为CT111、CT224等后续管线药物的全球开发奠定了技术基础。此次双成果亮相SITC,证明了我们‘平台研发+精准转化’模式的成功,也展现了上海细胞治疗集团与Chantibody在靶点发现、抗体工程及临床前研究全链条的协同优势。接下来,我们将加速推进两款药物的临床转化,打造更多全球首创的肿瘤免疫治疗方案。”
作为全球癌症免疫治疗领域的重要协同力量,上海细胞治疗集团与Chantibody始终秉持“技术同源、优势互补”的研发理念,依托从底层平台到药物管线的全产业链布局,持续推动肿瘤治疗技术的创新突破。此次在SITC年会同步展示专利平台与重磅药物成果,不仅展现了中美协同研发模式的高效性,更以“平台获专利、药物显疗效”的双重突破,为全球肿瘤免疫治疗的发展注入新动能。
