4月25日-30日,备受关注的美国癌症研究协会(AACR)年会在美国芝加哥召开,本届会议以“统一癌症科学与医学:持续创新带来变革”为主题。秉持“疗效为核,百姓可及”的药物开发理念,上海细胞治疗集团持续推动JL-闪CAR-T™为核心的关键技术平台开发,实现原创非病毒载体基因写入技术、纳米抗体VHHMAb®技术等底层技术的持续突破,加速创新治疗药物开发进程。本次会议,集团共有5项最新研究成果获邀现场展示,覆盖从底层平台突破到优势抗体发现,再到临床应用转化的完整药物开发体系。充分展现了集团在革新CAR-T等创新细胞药物可及性和治愈性方面的前瞻布局及广阔前景。

CT111为一款三靶点(PD1×CTLA4×VFGF)特异性纳米抗体,由上海细胞治疗集团与其美国子公司Chantibody(CHANTIBODY THERAPEUTICS INC.)基于第四代纳米抗体VHHMAb®技术平台开发,旨在整合双重免疫检查点和VEGF阻断作用,从而协同克服实体瘤内的免疫抑制环境,在PBMC人源化肿瘤模型中展现出显著的抗肿瘤活性。CT111通过三重机制(免疫激活+血管正常化+Treg抑制)突破现有疗法耐药性,尤其适用于PD-(L)1耐药性实体瘤,显著提高适用人群和疗效。其小分子特性可能改善药物分布,而且剂量优势可降低治疗成本,改善药物可及性。该策略不仅为提高抗肿瘤治疗效果提供了全新方案,也为未来多靶点免疫治疗药物的研发和临床转化开辟了崭新道路,展现出极大的应用前景。

摘要号:6068
摘要题目:
CT111, a novel trispecific PD-1 × CTLA-4 × VEGF single-domain antibody, synergistically targets exhausted T cells and promotes cooperative antitumor effects
摘要内容:
目前,双重免疫检查点抑制(如PD-1与CTLA-4)的治疗策略已被用于多种实体瘤;同时,抗PD-(L)1与抗VEGF联合用药也显示出较好的疗效。CT111是全球首款靶向PD-1、CTLA-4和VEGF的单域三特异性抗体(VHH结构),通过同时阻断免疫检查点和血管生成通路,显著增强抗肿瘤协同效应。采用新型抗VEGF单域抗体(非贝伐珠单抗衍生物),抑制活性更强;体积较传统双抗(如AK104/AK112)缩小30%-40%,可能提升肿瘤组织渗透性 (图1)。
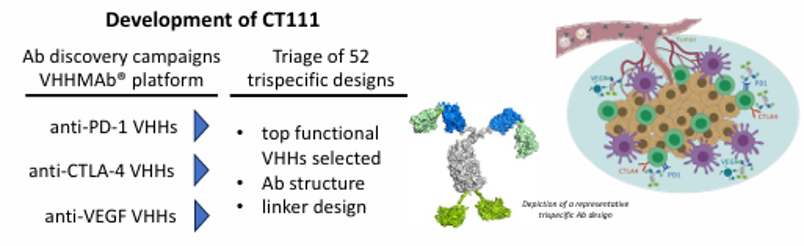
图 1
相比AK104、AK112等临床抗体,CT111在体外结合亲和力和阻断能力更强 (图2)。CT111更具有强效T细胞激活:在CMV回忆和SEB刺激实验中,CT111显著促进IL-2分泌,逆转T细胞耗竭,效果优于临床对照药(AK104/AK112)(图3)。
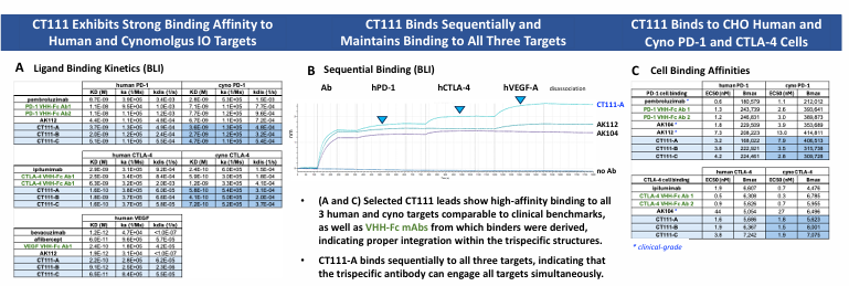
图 2a
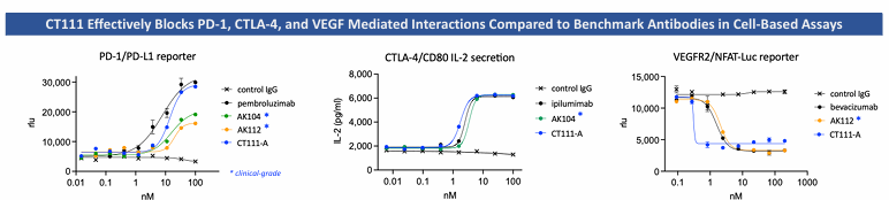
图 2b
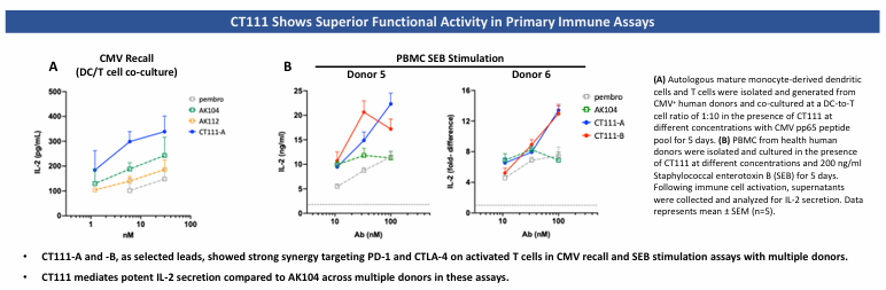
图 3
在HCC827非小细胞肺癌人源化模型中,CT111(1×剂量)的抑瘤效果超过AK104(5×剂量)和AK112(1×剂量);显著增加瘤内CD8+ T细胞浸润(激活标志CD103+/CD137+上调),同时降低Treg比例(类似AK104 5×剂量的效果)。小鼠实验显示良好稳定性,无显著体重下降,安全性良好 (图4)。
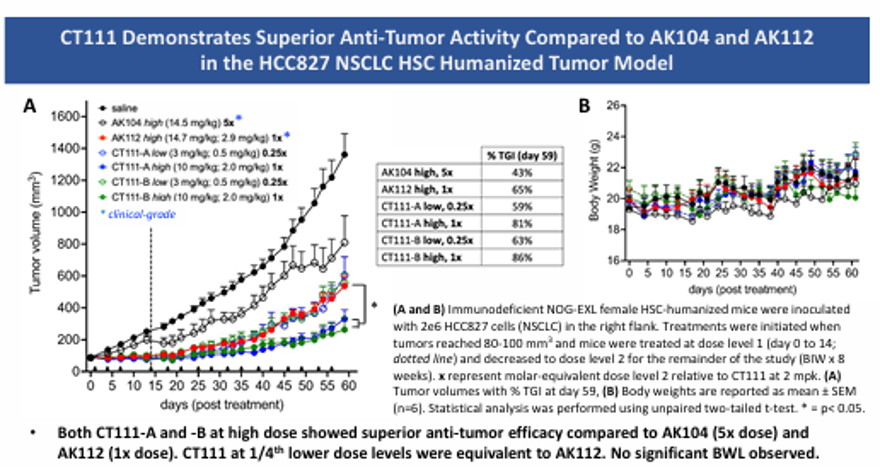
图 4a
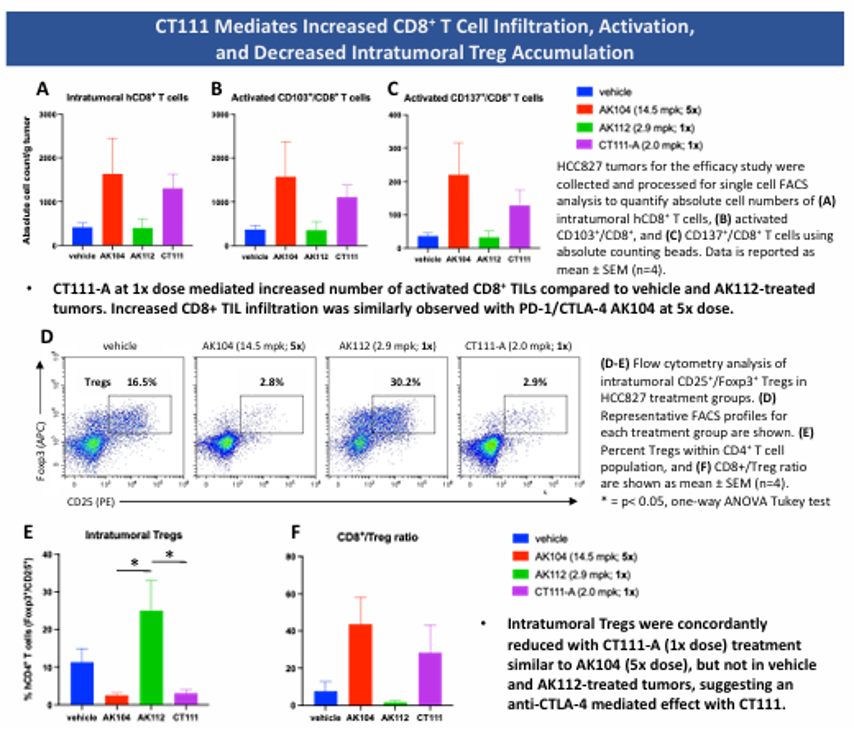
图 4b
此外CT111表现出良好的体内药代动力学特性及生物稳定性。在BALB/c小鼠体内也有较长的半衰期和稳定性 (图5)。
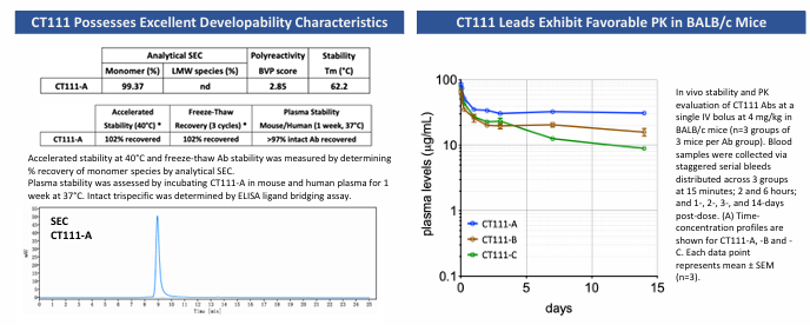
图 5
结论:
1. 靶点结合:BLI实验证实CT111可同时高亲和力结合人/食蟹猴PD-1、CTLA-4和VEGF。
2. 体外活性:在DC-T细胞共培养模型和SEB刺激实验中,CT111诱导的IL-2分泌量显著高于AK104(p<0.05)。
3. 体内疗效:HCC827模型显示,CT111治疗组肿瘤生长抑制率(TGI)达70%以上(AK112为50%)。
4. 安全性:加速稳定性实验(40°C/冻融)和血浆ELISA验证其理化性质稳定。
