4月25日-30日,备受关注的美国癌症研究协会(AACR)年会在美国芝加哥召开,本届会议以“统一癌症科学与医学:持续创新带来变革”为主题。秉持“疗效为核,百姓可及”的药物开发理念,上海细胞治疗集团持续推动JL-闪CAR-T™为核心的关键技术平台开发,实现原创非病毒载体基因写入技术、纳米抗体VHHMAb®技术等底层技术的持续突破,加速创新治疗药物开发进程。本次会议,集团共有5项最新研究成果获邀现场展示,覆盖从底层平台突破到优势抗体发现,再到临床应用转化的完整药物开发体系。充分展现了集团在革新CAR-T等创新细胞药物可及性和治愈性方面的前瞻布局及广阔前景。

上海细胞治疗集团与其美国子公司Chantibody(CHANTIBODY THERAPEUTICS INC.)基于第四代纳米抗体VHHMAb®平台开发并首次展示了一系列抗CD3以及肿瘤特异性靶点的纳米抗体(VHH),这些抗体在结合方式、亲和力、激活T细胞的能力以及针对多种肿瘤抗原TAA(例如CDH17, BCMA, CD19)的不同结构域上均表现出显著多样性,可实现高效、可模块化的TCE设计。
其中CT224作为全VHH双特异性TCE,凭借其分子小、易拼接、多表位覆盖的独特优势,有望为CRC等CDH17阳性实体瘤带来更高效、更安全的治疗方案。

摘要号:5465
摘要题目:
A novel CD3 VHH-based multi-specific T cell engager platform and multiple leads for colorectal cancer and auto-immune diseases
摘要内容:
T细胞连接器(TCE)作为新一代免疫治疗药物,展现出在癌症以及自身免疫病等疾病治疗中的巨大潜力。但开发过程中仍面临抗体筛选、T细胞激活程度与治疗窗口等多重挑战。为了更大程度的开发TCE的潜力,我们成功利用具有自主知识产权的第四代VHHMAb®平台,从抗原免疫中成功发现了一系列抗CD3以及肿瘤特异性靶点的纳米抗体(VHH),这些抗体在结合方式、亲和力、激活T细胞的能力以及针对多种肿瘤抗原(TAA)的不同结构域上均表现出显著多样性。通过多源免疫策略(羊驼、美洲驼和骆驼)进行细胞+蛋白+mRNA免疫,捕获了全谱的抗体候选分子,进一步借助自主研发的AI平台进行分子设计优化,获得了多样化的低免疫原性的人源化抗CD3 VHH以及肿瘤特异靶点(例如CDH17, BCMA, CD19)。
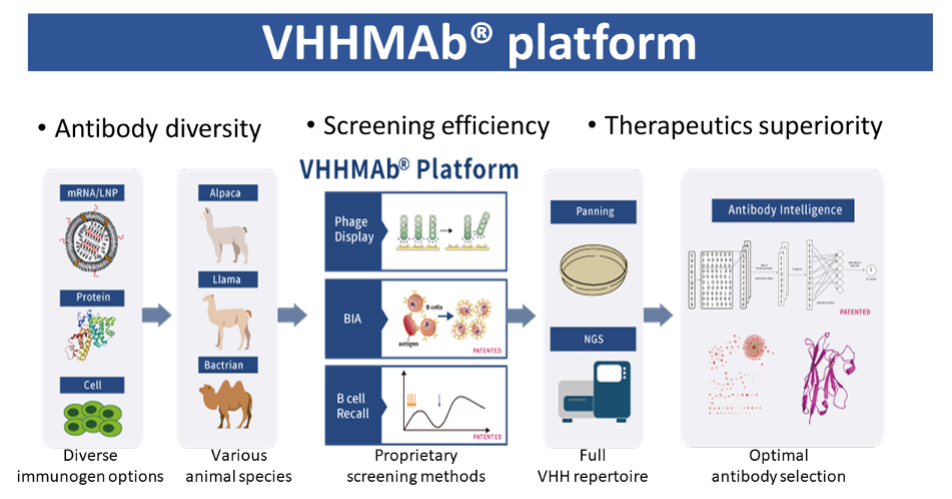
VHHMAb®平台开发多样化抗CD3 VHH库:从约10,000个ELISA结合克隆中筛选抗CD3 VHH,测定其亲和力跨度从 nM 至数百 nM,并根据结合动力学分入不同“binding bin”,进一步在T细胞表面结合实验(FACS)中评估每个VHH的结合强度,成功获得了多样化人源化低免疫原性的抗CD3 VHH库,涵盖了CD3复合物的不同表位、亲和力及T细胞激活特性,为TCE构建提供了丰富候选资源(图1)。
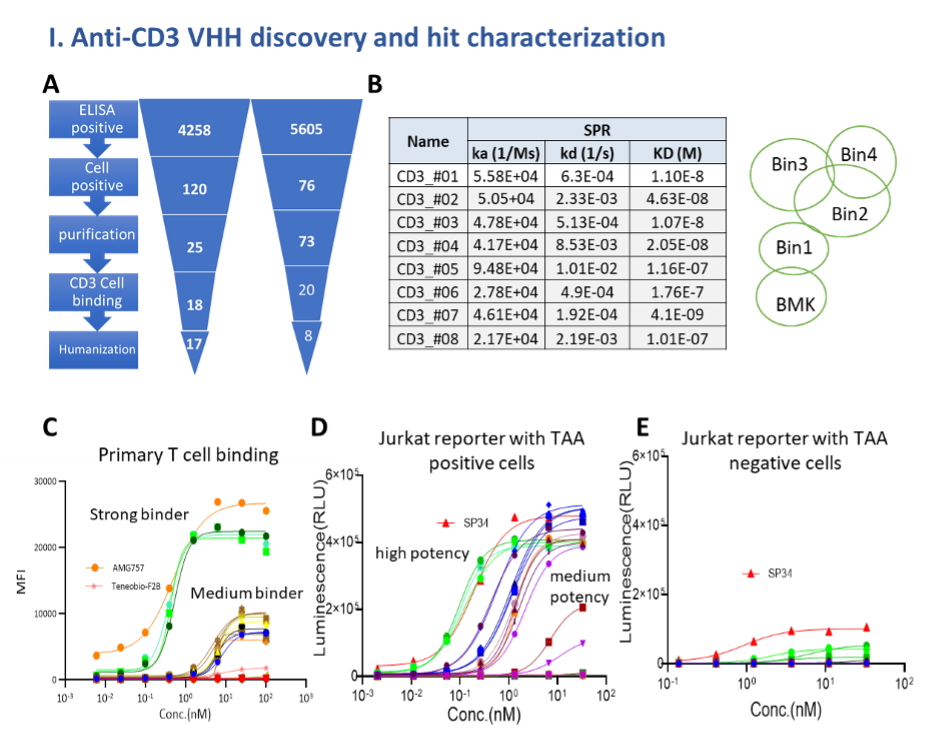
Figure 1. (A) VHHs discovery funnel starting from around 10,000 ELISA binding clones. (B) Affinity of anti-CD3 VHHs ranging from nM to hundreds of nM, and are categorized into different binding bins (8 hit examples shown). (C) Binding profiles of anti-CD3 VHHs to T cells. (D, E) T cell activation in a TCE format with antigen-positive (D) and antigen-negative (E) cells. Identified anti-CD3 VHHs display varying T cell activation potencies.
VHHMAb®平台开发多样化抗CDH17 VHH库:结直肠癌(CRC)靶点有限,CDH17在CRC中差异高表达,是优选的肿瘤相关抗原之一。选择CDH17作为靶点,通过VHHMAb®平台,获得了针对不同CDH17结构域(Domian1-Domain7)的VHH库。
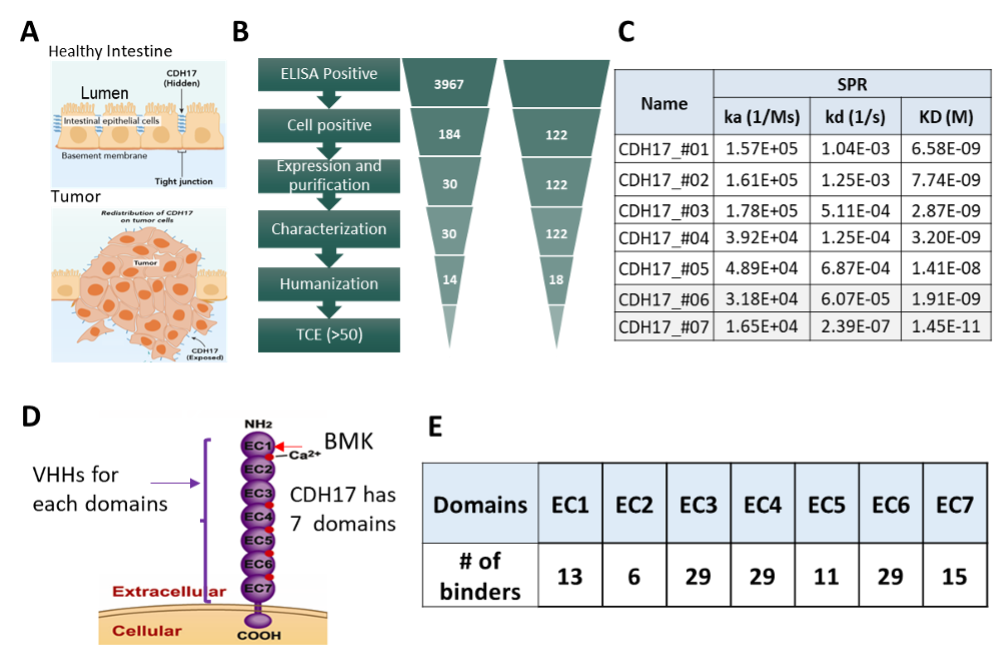 Figure 2. (A) CDH17 is overexpressed in tumors and loses its polarized distribution seen in healthy intestines. (B) VHHs discovery funnel starting from around 4000 ELISA binding clones. (C) Affinity of anti-CDH17 VHHs ranging from nM to pM. (D) CDH17 consists of 7 extracellular domains EC1-EC7. (E) Selected VHHs covering all 7 domains of CDH17 and are cross-reactive with human, cyno, and mouse CDH17.
Figure 2. (A) CDH17 is overexpressed in tumors and loses its polarized distribution seen in healthy intestines. (B) VHHs discovery funnel starting from around 4000 ELISA binding clones. (C) Affinity of anti-CDH17 VHHs ranging from nM to pM. (D) CDH17 consists of 7 extracellular domains EC1-EC7. (E) Selected VHHs covering all 7 domains of CDH17 and are cross-reactive with human, cyno, and mouse CDH17.
构建CT224(CDH17×CD3双特异性TCE):利用自主AI平台对不同CD3和CDH17 VHH组合进行空间构象模拟与生物物理属性预测,优化分子大小、柔性铰链和Fc构象以促进免疫突触形成。(图3)
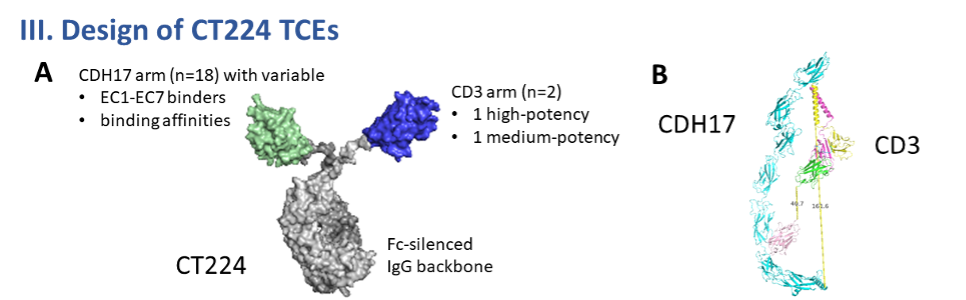
Figure 3. VHHs with different CDH17-domain binding and CD3 potency are used to design the CT224 TCEs. For optimal synapse and good developability, ML/AI powered designs are used.
CT224候选分子的多维功能验证与候选药物筛选:通过体外TDCC筛选,在CDH17高表达(H716)、中表达(DLD-1、COLO-205)及低/阴性(HCT-15)多株肿瘤细胞系中,测定不同CT224 TCE的剂量依赖性细胞杀伤率,并确认膜近端域(MP)靶向分子优于膜远端域(MD)分子(图 4)。
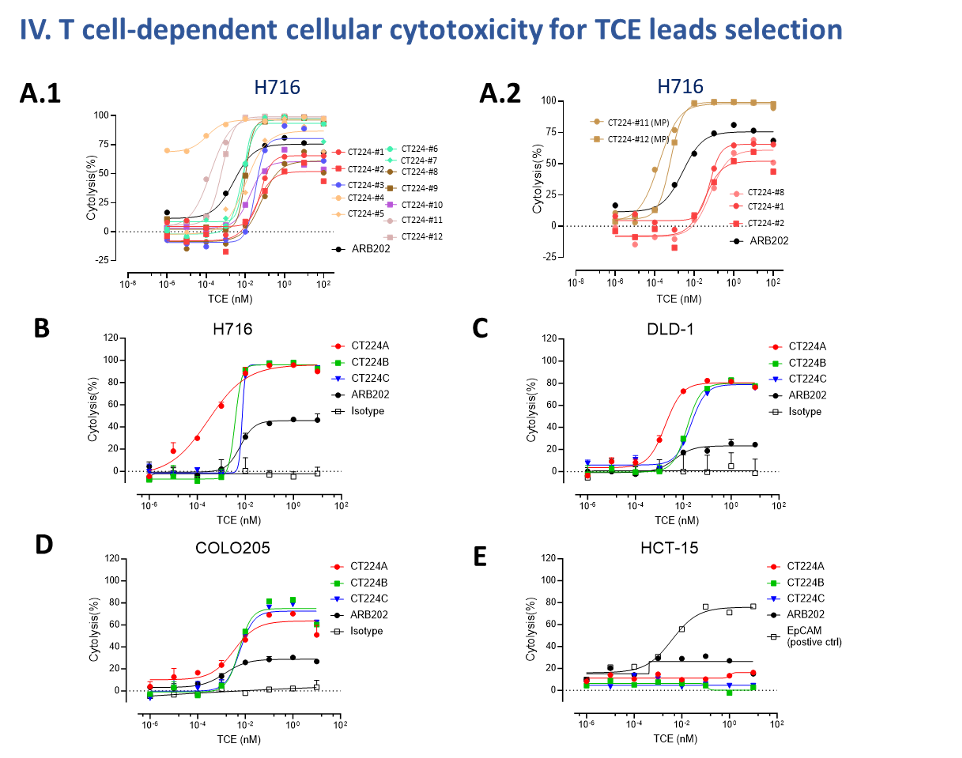
Figure 4. (A) Screening for potent CT224 by TDCC assay. (A.1) Range of cytolysis by different TCEs with CDH17 high (H716) cells. (A.2) TCEs targeting membrane proximal (MP) domains showed higher killing capacity than the membrane distal (MD) domains. (B-E) Leads CT224A/B/C were selected for further validation. Leads have broader killing of CDH17 positive cells H716(B), DLD-1 (C) and COLO-205 (D) and no cytotoxicity on CDH17-low/negative HCT-15 (E).
CT224候选药物的人源化小鼠模型验证:在PBMC 人源化MHC dKO NOG小鼠AsPC-1异种移植模型中,CT224C(2 mg/kg,每周i.p.一次)较临床参比ARB202(5 mg/kg,等摩尔浓度)显著抑制肿瘤生长(***p < 0.001),且动物体重稳定,无明显毒性信号(图 5A–B)。
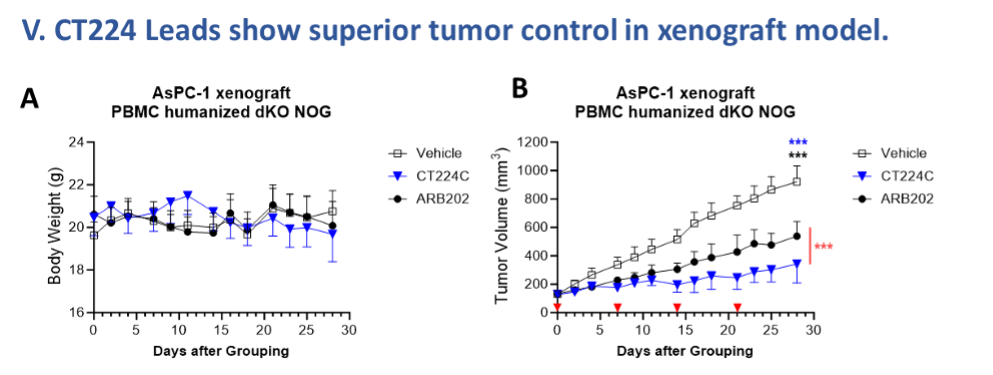 Figure 5. PBMC humanized MHC dKO NOG mice bearing AsPC-1 tumors were treated intraperitoneally (i.p.) once weekly (QW) with 2 mg/kg CT224C and 5 mg/kg ARB202 (equimolar). (A) Body weight and (B)Tumor volume were monitored twice a week, calculated by a two-way ANOVA test, ***p<0.001.
Figure 5. PBMC humanized MHC dKO NOG mice bearing AsPC-1 tumors were treated intraperitoneally (i.p.) once weekly (QW) with 2 mg/kg CT224C and 5 mg/kg ARB202 (equimolar). (A) Body weight and (B)Tumor volume were monitored twice a week, calculated by a two-way ANOVA test, ***p<0.001.
结论:
1. 全谱系、全流程、高通量抗体发现和改造:从克隆筛选、AI驱动设计到多维功能验证,一站式实现抗CD3与抗TAA VHH的模块化整合与最优TCE设计。
2. 灵活可调的Potency:通过不同亲和力与表位抗CD3 VHH组合,可为不同临床需求精准定制TCE激活强度与安全窗口。
3. 跨物种无缝衔接:候选分子兼容人源/猕猴/小鼠CDH17,为小鼠到NHP临床前研究及IND申报提供宝贵优势。
