4月25日-30日,备受关注的美国癌症研究协会(AACR)年会在美国芝加哥召开,本届会议以“统一癌症科学与医学:持续创新带来变革”为主题。秉持“疗效为核,百姓可及”的药物开发理念,上海细胞治疗集团持续推动JL-闪CAR-T™为核心的关键技术平台开发,实现原创非病毒载体基因写入技术、纳米抗体VHHMAb®技术等底层技术的持续突破,加速创新治疗药物开发进程。本次会议,集团共有5项最新研究成果获邀现场展示,覆盖从底层平台突破到优势抗体发现,再到临床应用转化的完整药物开发体系。充分展现了集团在革新CAR-T等创新细胞药物可及性和治愈性方面的前瞻布局及广阔前景。

BZE2204为一项全新的无需体外培养的超快速非病毒载体三靶点血液瘤CAR-T细胞治疗项目。由上海细胞治疗集团联合上海大学附属孟超肿瘤医院及美国子公司Chantibody(CHANTIBODY THERAPEUTICS INC.)共同开展。
BZE2204采用集团JL-闪CAR-T™制备工艺平台,最短制备工艺的时间为6小时(6h)完成从单采血到制剂的全过程,最大程度保证T细胞的干性和扩增能力,在临床前动物数据和IIT临床实验上都展现出了优异的抗肿瘤效果,是闪CAR-T制备技术创新与多靶点CAR设计创新的有机结合。
BZE2204体内扩增能力强,以常规市售CAR-T剂量的1/40,达到常规剂量产品30-200倍的 Cmax (CAR-T/ul)、17-150倍的AUC(CAR-T/ul*d)。目前6h工艺开展的IIT临床实验中,在难治复发弥漫大B淋巴瘤(r/r NHL)末线3例患者中达到临床客观缓解率ORR=100%,完全缓解率(CR)近70%(截止发稿时已更新至CR=100%),且毒副作用极小,无三级或以上CRS,无DLT。患者回输后恢复好,持续缓解比例高。
摘要号:3173
摘要题目:
JL-Lightning CAR-T,a Next Generation Non-viral CAR-T without In-Vitro Culturing Procedure, Shows High Clinical Efficacy, Good Safety with Low Dosage
摘要内容:
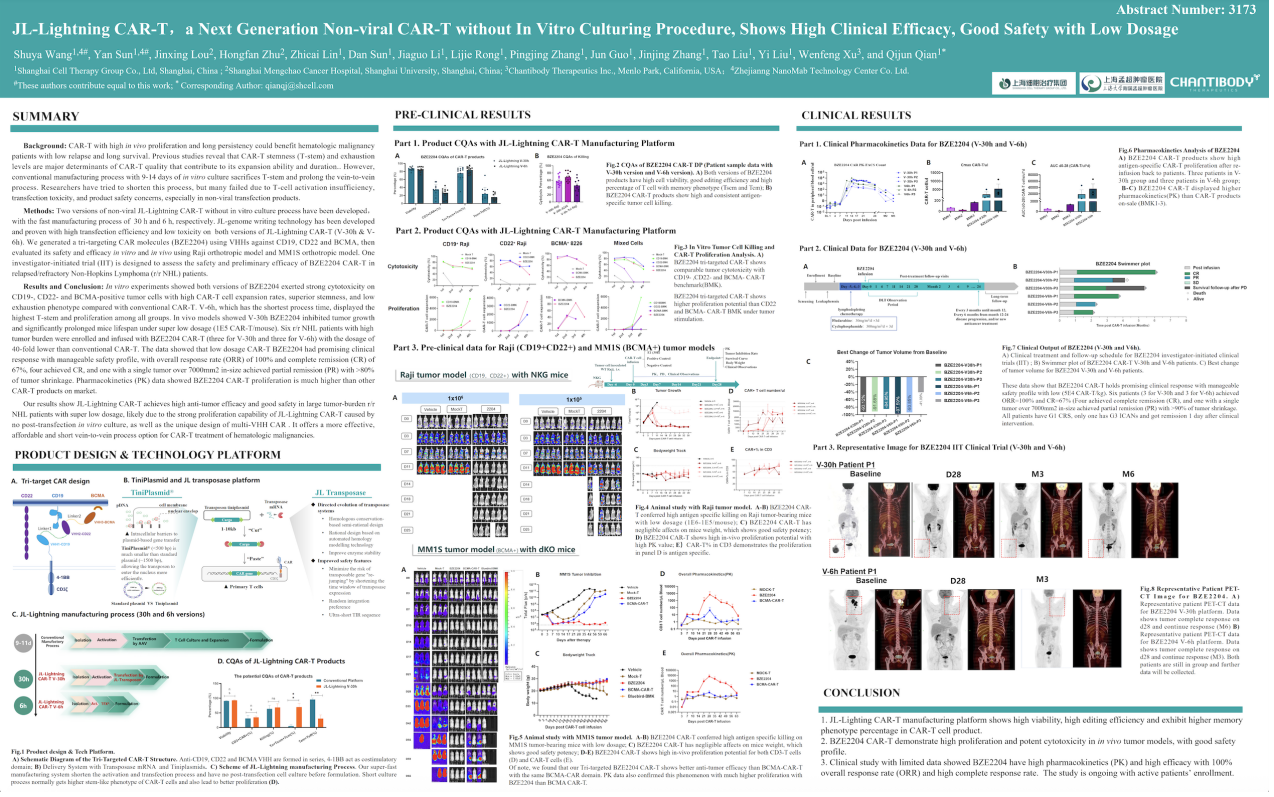
BZE2204是上海细胞治疗集团搭载JL-闪CAR-T™技术平台的三靶点血液肿瘤CAR-T产品,产品由anti-CD19, CD22 和 BCMA 三个VHH组成,以4-1BB 和CD3ζ作为胞内结构域。此设计理念,是为了使产品能深度杀伤各阶段的B细胞,达到疾病彻底缓解的效果。同时,多CAR设计能有效防止CD19阴性的血液肿瘤复发,延长无进展生存期(PFS),使患者有更大的获益。同时,项目采用拥有自主知识产权的JL转座酶进行转座,相对市售其他转座子效率更高,毒性更低,安全(无插入偏好)高效。自有知识产权的“Tini-Plasmid”系统(太质粒) 也因其极小的骨架大小(~500bp)助力高效低毒的非病毒CAR基因转染。
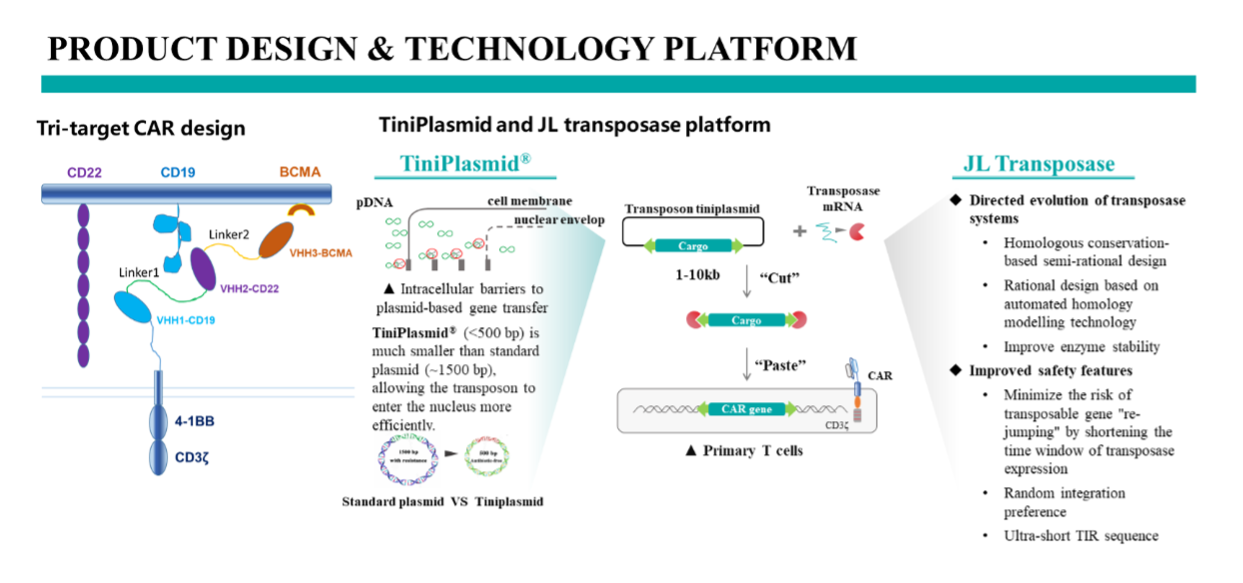 图 BZE2204项目的分子设计与转座技术平台
图 BZE2204项目的分子设计与转座技术平台
公司独创的JL-Lightning™无培养超快速非病毒CAR-T制备平台,利用上述的转座酶和太质粒系统,将市售产品传统工艺的9-11天制备时间缩短到30h(V-30h)和6h(V-6h).通过缩短体外培养时间,在保障活率、转染效率和CAR-T功能的前提下,大幅提高CAR-T产品的干性表型(Tscm+Tcm),提升体内扩增潜力,从而使得临床回输后能在更低的剂量下获得更高的药代动力学数据和更佳的临床疗效。
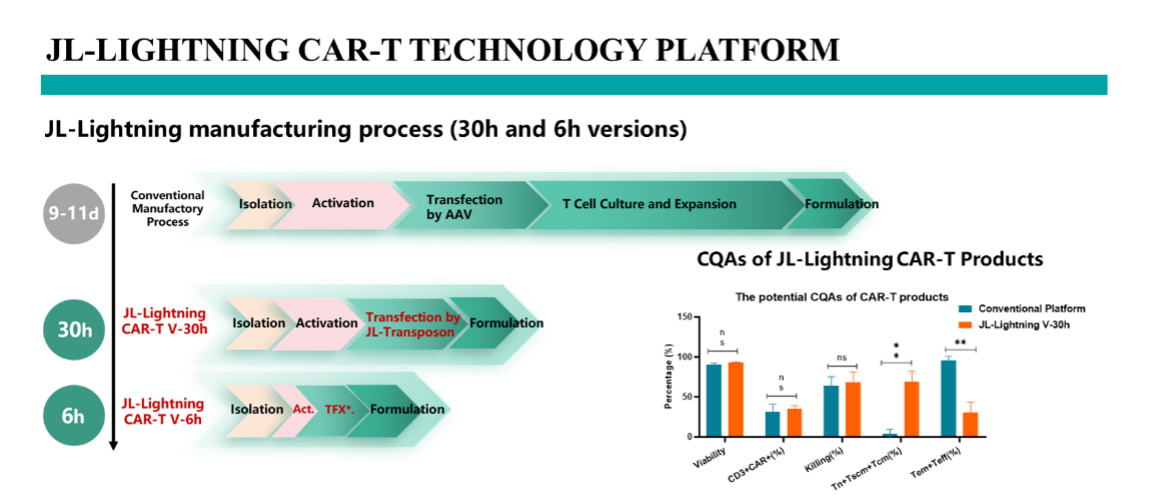 图 JL-Lightning™无培养超快速非病毒CAR-T制备平台
图 JL-Lightning™无培养超快速非病毒CAR-T制备平台
临床前动物数据显示,BZE2204在极低剂量下(1E5 CAR-T/mice)可以使Raji肿瘤消退(CD19+CD22+),肿瘤消退呈现剂量依赖。小鼠的生存曲线展示产品良好的安全性。CAR-T体内扩增数据也显示产品极佳的扩增效率,是低剂量下控制肿瘤生长的重要因素。
 图 临床前体内实验数据(Raji肿瘤模型)
图 临床前体内实验数据(Raji肿瘤模型)
临床前动物数据显示,BZE2204能高效控制BCMA+的MM1S肿瘤模型在小鼠体内的生长。数据对比了两种BCMA单表达的CAR-T(我公司的BCMA-CAR-T和市售竞品BCMA CAR-T)和BZE2204三靶点CAR-T的肿瘤抑制效率。结果显示,BZE2204产品的三靶点CAR-T在扩增和肿瘤抑制效率上优于单BCMA CAR-T(BCMA-CAR分子相同),两款产品优于市售的BCMA-CAR-T产品。BZE2204产品更展示了良好的防复发效果(d21及以后),相对单靶点BCMA-CAR-T,本产品能更长时间的抑制肿瘤复发,预示着临床可能有更长的无进展生存期获益。小鼠的生存曲线同时展示产品良好的安全性。
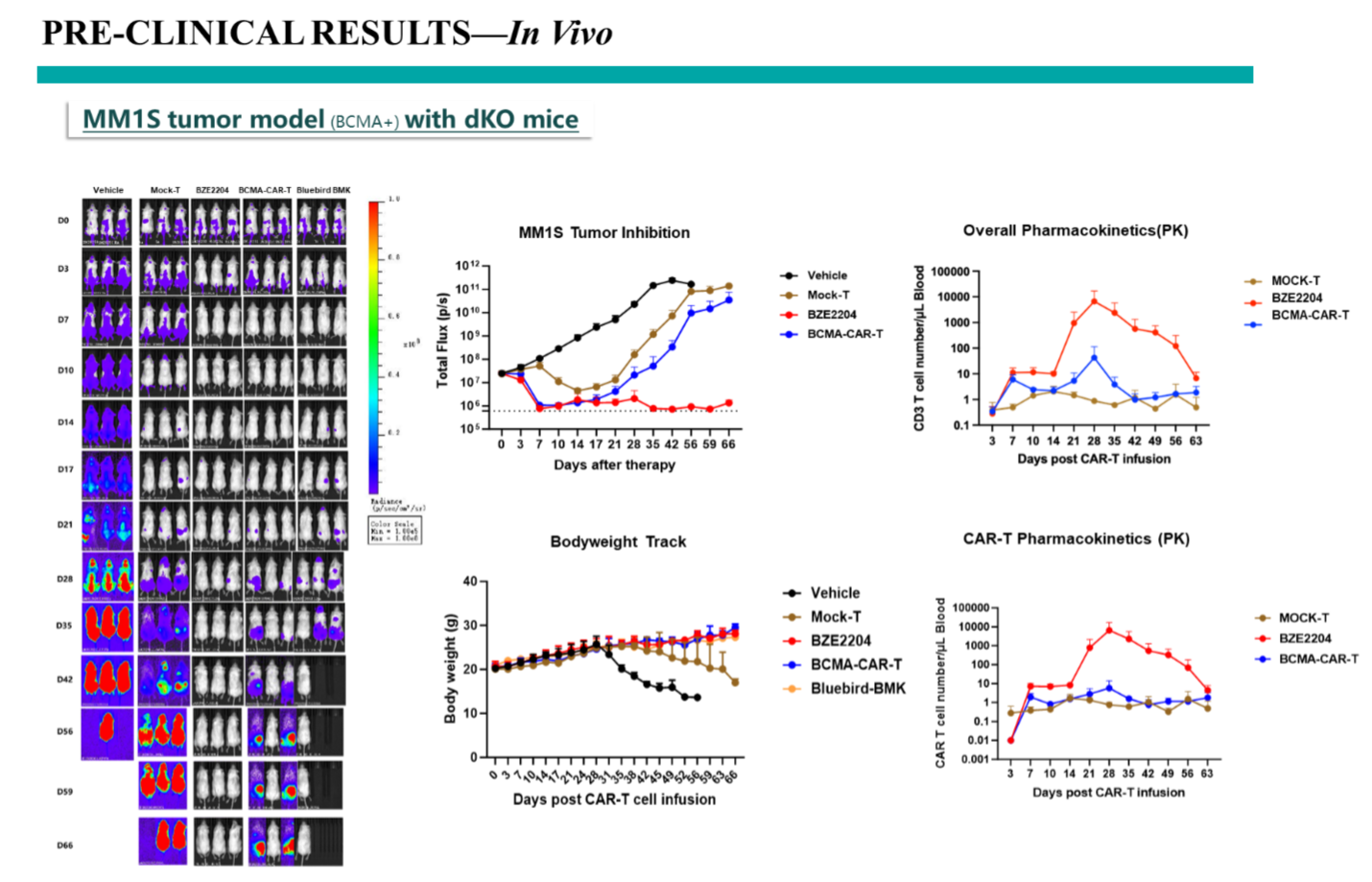 图 临床前体内实验数据(MM1S肿瘤模型)
图 临床前体内实验数据(MM1S肿瘤模型)
临床方案设计与中剂量组(5E4 CAR-T/kg)在V-30和V-6h两个工艺下的IIT临床数据。数据显示中剂量组6名患者ORR均为100%,CR%=67%(截止发稿时,V-6h的三名患者已达成完全缓解率(CR)=100%).V-30h工艺中未达成CR的患者肿瘤负荷极大(单个肿瘤负荷超过7000mm2),经过治疗肿瘤已经消退超过90%。产品安全性良好,所有患者均只有G1 CRS,只有一例患者出现G3 ICANS并在临床干预1天以后缓解。
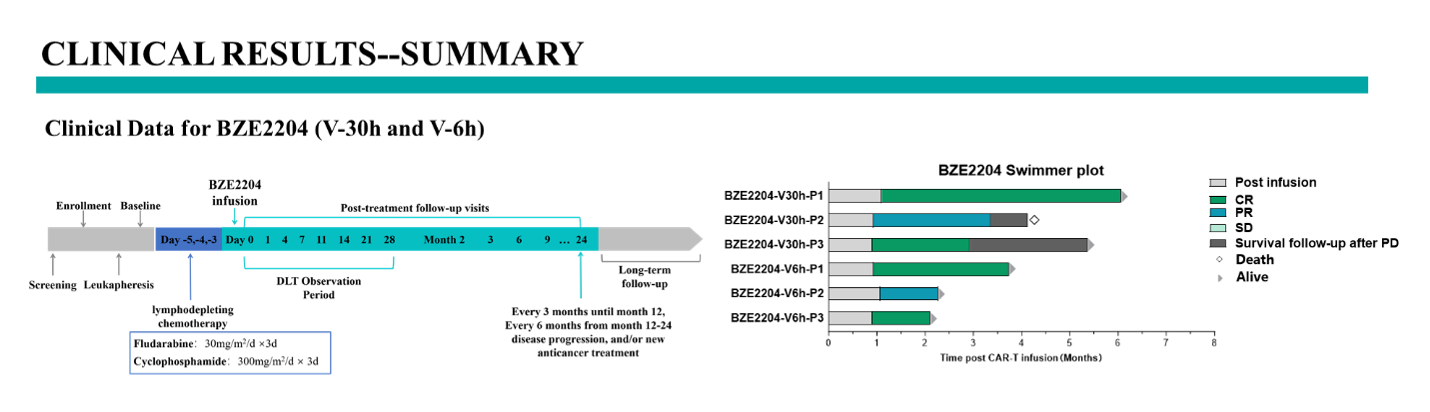 图 临床实验方案及数据汇总
图 临床实验方案及数据汇总
临床药代动力学数据(PK)显示BZE2204 CAR-T产品极高的体内扩增能力。与其他CAR-T快速工艺类似,BZE2204产品达峰时间(Tmax)为d14左右,但以低于市售产品1/40的剂量下达到常规剂量产品30-200倍的 Cmax (CAR-T/ul), 以及17-150倍的AUC(CAR-T/ul*d),且毒副作用小,无3级或以上的CRS,无DLT,展示了产品高效低毒的扩增模式。
(市售数据均来自公开发表的参考文献)
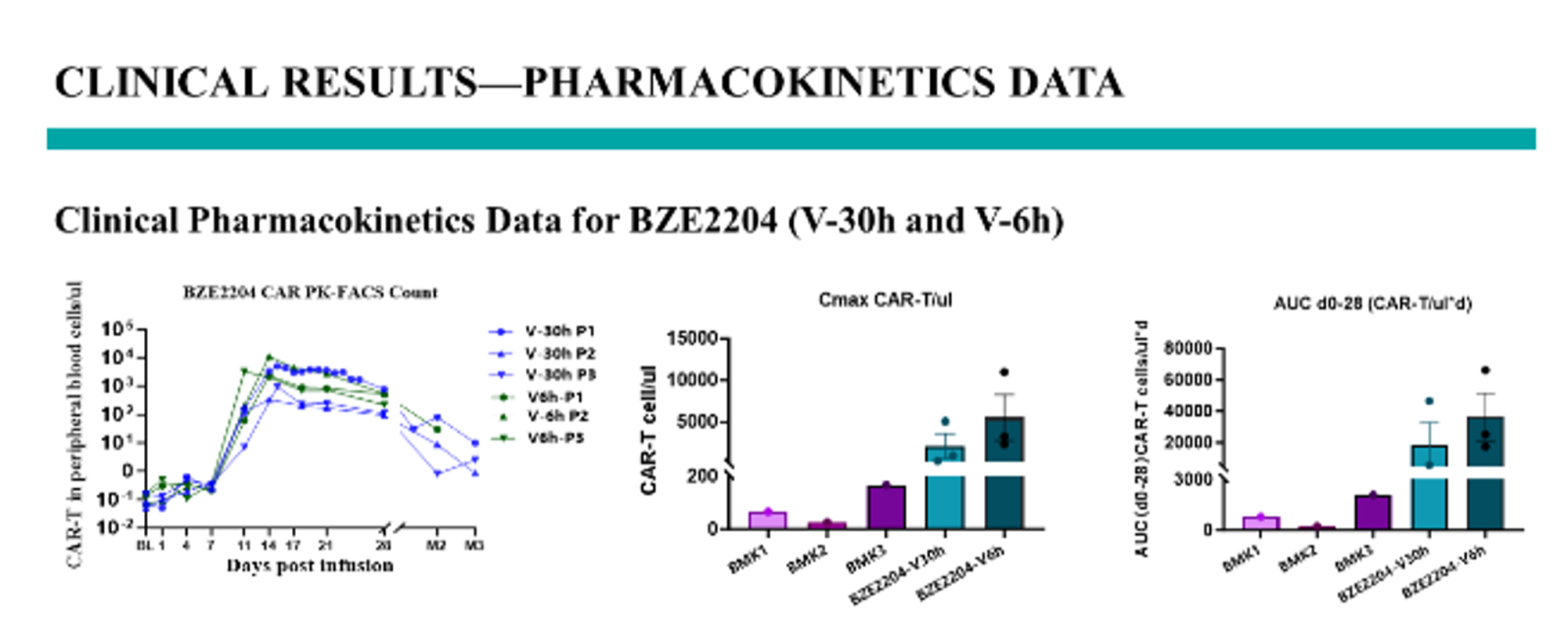 图 临床药代动力学数据汇总及与市售产品对比
图 临床药代动力学数据汇总及与市售产品对比
代表性患者临床数据显示V-30h和V-6h的患者的基线数据和在接受BZE2204 JL-Lightning CAR-T治疗后的随访期的PET-CT图。患者在接受BZE2204产品回输后,在28天内即达到肿瘤完全缓解(CR),并在后随访期中获得持续缓解。截至目前该剂量下V-30h患者最长随访期为6个月,V-6h组患者最长随访期为3个月,后续数据将持续更新。
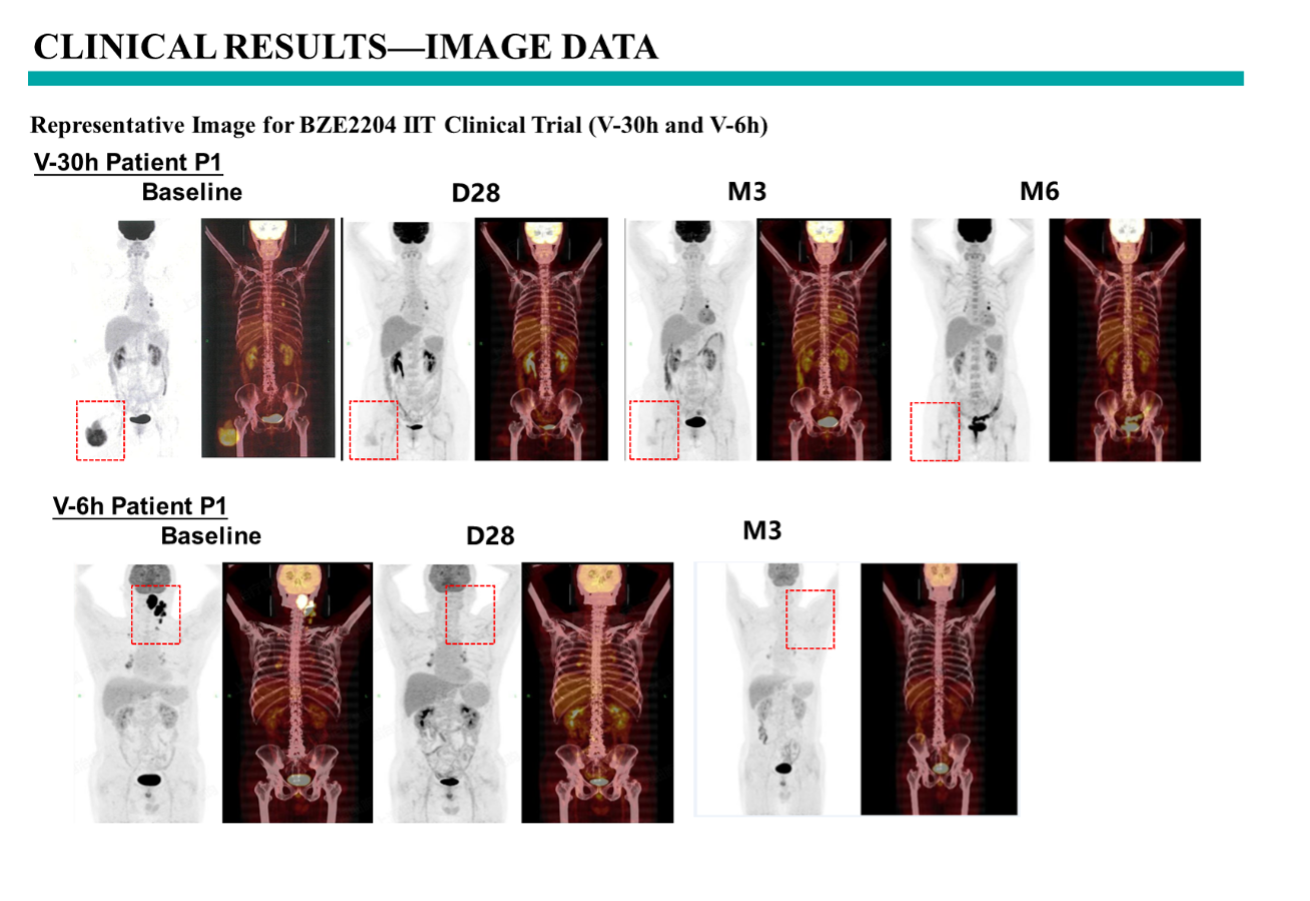 图 代表性患者临床PET-CT数据展示(V-30h与V-6h)
图 代表性患者临床PET-CT数据展示(V-30h与V-6h)
结论:
1. JL-Lighting CAR-T 无培养超快速平台工艺搭载JL转座酶及太质粒系统,展示了非病毒工艺下高效低毒、高活低分化的领先的CAR-T制备工艺。
2.临床前数据证明了BZE2204 CAR-T产品在小鼠体内高增值潜力、高肿瘤抑制效率及高安全性的特点,符合临床前评估的预期。
3. 现有临床数据展示BZE2204 拥有极高的药代动力学扩增能力(PK)和在极低剂量下优秀的体内疗效(ORR=100%,CR>67%).临床实验还在进一步开展中。
